一、項目名稱:保健食品審批
二、許可內容:進口(含港、澳、臺)保健食品在境外轉讓產品注冊
三、實施依據:《中華人民共和國食品安全法》、《保健食品注冊管理辦法(試行)》、《保健食品行政許可受理審查要點》
四、收費:不收費
五、數量限制:本許可事項無數量限制
六、申請人提交材料目錄:
資料編號(一)保健食品技術轉讓產品注冊申請表;
資料編號(二)受讓方生產國(地區)允許該產品生產銷售的證明文件,該證明文件應當經生產國(地區)的公證機關公證和駐所在國中國使領館確認;
資料編號(三)受讓方所在國家(地區)有關機構出具的該產品生產企業符合當地相應生產質量管理規范的證明文件;
資料編號(四)轉讓合同,該合同必須經受讓方所在國家(地區)公證機關公證和駐所在地中國使領館確認;
資料編號(五)由境外廠商常駐中國代表機構辦理注冊事務的,應當提供《外國企業常駐中國代表機構登記證》復印件。境外生產廠商委托境內的代理機構負責辦理注冊事項的,需提供經過公證的委托書原件以及受委托的代理機構營業執照復印件;
資料編號(六)保健食品批準證明文件原件(包括保健食品批準證書及其附件和保健食品變更批件);
資料編號(七)確定的檢驗機構出具的受讓方生產的連續3個批號樣品的功效成份或標志性成分、衛生學、穩定性試驗的檢驗報告;
資料編號(八)2年內無違法違規行為的承諾書;
資料編號(九)受讓方生產的連續三個批號的樣品,其數量為檢驗所需量的3倍。
七、對申報資料的要求:
(一)申報資料的一般要求:
1、申報資料首頁為申報資料項目目錄,目錄中申報資料項目按《保健食品技術轉讓產品注冊申請表》中“所附資料”順序排列。每項資料加封頁,封頁上注明產品名稱、申請人名稱,右上角注明該項資料名稱。各項資料之間應當使用明顯的區分標志,并標明各項資料名稱或該項資料所在目錄中的序號。整套資料用打孔夾裝訂成冊。
2、申報資料使用A4規格紙張打印(中文不得小于宋體小4號字,英文不得小于12號字),內容應完整、清楚,不得涂改。
3、技術轉讓產品注冊申請應提交原件1份。
4、除《保健食品注冊申請表》、檢驗機構出具的檢驗報告、公證文書、官方證明文件及第三方證明文件外,申報資料應逐頁加蓋申請人印章或騎縫章,多個申請人聯合申報的,應加蓋所有申請人印章,技術轉讓應加蓋轉讓方和受讓方印章。印章應加蓋在文字處。印章應符合國家有關用章規定,并具法律效力。進口保健食品申請人若無印章,可以法人代表簽字或簽名章代替。
5、多個申請人聯合申報的,應提交聯合申報負責人推薦書。
6、申報資料中同一內容(如產品名稱、申請人名稱、申請人地址等)的填寫應前后一致。電子版與文字版的同一內容(產品名稱、申請人名稱、申請人地址、產品配方、試制單位名稱、試制單位地址、試驗單位名稱、產品受理編號)應當一致。
7、產品配方、生產工藝、質量標準、標簽與說明書及有關證明文件中的外文,均應譯為規范的中文;外文參考文獻中的摘要、關鍵詞及與產品保健功能、安全有關部分的內容應譯為規范的中文(外國人名、地址除外)。
8、非首次申請的申報資料應提供撤審通知書或不予批準通知書復印件(加蓋申請人公章),還應提供再次申報的理由,附于申報資料的首頁。
9、技術轉讓產品注冊申請中,申請人營業執照的名稱、地址與保健食品批準證書中申請人名稱、地址應當一致。對于不一致的情況,應當要求申請人提供已經備案的證明資料(加蓋申請人單位公章)。
10、對于變更申請、技術轉讓產品注冊申請,申請人應當在保健食品批準證書有效期屆滿3個月前提出;再注冊申請已受理的,不再同時受理該產品的變更和技術轉讓產品注冊申請;已受理的產品變更和技術轉讓產品注冊申請,申請人應當在獲得批準后30日內提出再注冊申請。
11、上述各類復印件應當加蓋原件持有單位公章。
(二)申報資料的具體要求:
1、保健食品技術轉讓產品注冊申請表。
(1) 保健食品技術轉讓產品注冊申請表可從國家食品藥品監督管理局網站(www.sfda.gov.cn)或國家食品藥品監督管理局保健食品審評中心網站(www. bjsp.gov.cn)下載。
(2)填寫前應認真閱讀填表須知,按要求填寫。
(3)申請表內容須打印填寫,項目填寫應完整、規范,不得涂改。
(4)申報的保健功能應與國家食品藥品監督管理局公布的保健食品功能名稱一致。申報的新功能除外。
(5)進口保健食品申請人為產品所有權的擁有者,生產企業為產品的實際生產者(申報產品由申請人自行生產的,生產企業即為申請人;申報產品由申請人委托境外其它企業生產的,生產企業即為被委托企業)。
(6)產品名稱應包括品牌名、通用名和屬性名。
2、受讓方生產國(地區)允許該產品生產銷售的證明文件,該證明文件應當經生產國(地區)的公證機關公證和駐所在國中國使領館確認。
3、受讓方所在國家(地區)有關機構出具的該產品生產企業符合當地相應生產質量管理規范的證明文件。
4、轉讓合同。該合同必須經受讓方所在國家(地區)公證機關公證和駐所在地中國使領館確認。應譯為規范的中文,并經中國境內公證機構公證。
5、由境外廠商常駐中國代表機構辦理注冊事務的,應當提供《外國企業常駐中國代表機構登記證》復印件。境外生產廠商委托境內的代理機構負責辦理注冊事項的,需提供經過公證的委托書原件以及受委托的代理機構營業執照復印件(申請人應當分別申請延續、變更、補發、糾錯等事項,在完成一個申請事項后,方可申請其他事項)。
6、保健食品批準證明文件原件(包括保健食品批準證書及其附件和保健食品變更批件)。
7、確定的檢驗機構出具的受讓方生產的連續3個批號樣品的功效成份或標志性成分、衛生學、穩定性試驗的檢驗報告。
8、2年內無違法違規行為的承諾書。
9、受讓方生產的連續3個批號的樣品,其數量為檢驗所需量的3倍。
八、申辦流程示意圖:
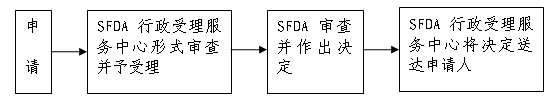
九、許可程序:
(一)受理:
申請人向行政受理服務中心提出申請,按照本《須知》第六條所列目錄提交申請材料,受理中心工作人員按照“《保健食品注冊管理辦法》附件三:進口保健食品在境外轉讓產品注冊申請申請資料項目”對申請材料進行形式審查。申請事項依法不需要取得行政許可的,應當即時告知申請人不受理;申請事項依法不屬于本行政機關職權范圍的,應當即時作出不予受理的決定,并告知申請人向有關行政機關申請;申請材料存在可以當場更正的錯誤的,應當允許申請人當場更正;申請材料不齊全或者不符合法定形式的,應當當場或者在五日內一次告知申請人需要補正的全部內容,逾期不告知的,自收到申請材料之日起即為受理;申請事項屬于本行政機關職權范圍,申請材料齊全、符合法定形式,或者申請人按照本行政機關的要求提交全部補正申請材料的,應當受理行政許可申請。
(二)檢驗與核查:
自受理之日起,國家食品藥品監督管理局在5日內向確定的檢驗機構發出檢驗通知書并提供檢驗用樣品。根據需要,國家食品藥品監督管理局可以對受讓方產品的生產現場進行核查。
收到檢驗通知書和樣品的檢驗機構,應當在30日內對樣品進行樣品檢驗,將檢驗報告報送國家食品藥品監督管理局,同時抄送申請人。
(三)技術審評和行政審查:
國家食品藥品監督管理局應當在收到樣品檢驗報告后的20日內作出審查決定。在審查過程中,需要補充資料的,國家食品藥品監督管理局應當一次性提出。申請人應當在收到補充資料通知書后的5個月內提交符合要求的補充資料,未按規定時限提交補充資料的予以退審。特殊情況,不能在規定時限內提交補充資料的,必須向國家食品藥品監督管理局提出書面申請,并說明理由。申請人補充資料時間不計入許可時限,其審查時限在原審查時限的基礎上延長30日。準予注冊的,向受讓方頒發新的《進口保健食品批準證書》和新的批準文號,證書的有效期不變,同時收繳并注銷轉讓方原取得的《進口保健食品批準證書》。不予注冊的,應當書面說明理由。
(四)送達:自行政許可決定作出之日起10日內,SFDA行政受理服務中心將行政許可決定送達申請人。
十、承諾時限:
自受理之日起,在55日內作出許可決定。
十一、實施機關:
實施機關:國家食品藥品監督管理局
受理地點:國家食品藥品監督管理局行政受理服務中心
十二、許可證件有效期與延續:
新發的《進口保健食品批準證書》有效期與原證書相同,有效期屆滿需要延長有效期的,申請人應當在有效期屆滿三個月前申請再注冊。
十三、許可年審或年檢:無
十四、受理咨詢與投訴機構:
咨詢:國家食品藥品監督管理局
投訴:國家食品藥品監督管理局駐局監察局、政策法規司執法監督處
注:本須知工作期限以工作日計算,不含法定節假日
 標簽:產品注冊 保健食品注冊 許可 行政許可 食品安全法 進口 保健食品
標簽:產品注冊 保健食品注冊 許可 行政許可 食品安全法 進口 保健食品
二、許可內容:進口(含港、澳、臺)保健食品在境外轉讓產品注冊
三、實施依據:《中華人民共和國食品安全法》、《保健食品注冊管理辦法(試行)》、《保健食品行政許可受理審查要點》
四、收費:不收費
五、數量限制:本許可事項無數量限制
六、申請人提交材料目錄:
資料編號(一)保健食品技術轉讓產品注冊申請表;
資料編號(二)受讓方生產國(地區)允許該產品生產銷售的證明文件,該證明文件應當經生產國(地區)的公證機關公證和駐所在國中國使領館確認;
資料編號(三)受讓方所在國家(地區)有關機構出具的該產品生產企業符合當地相應生產質量管理規范的證明文件;
資料編號(四)轉讓合同,該合同必須經受讓方所在國家(地區)公證機關公證和駐所在地中國使領館確認;
資料編號(五)由境外廠商常駐中國代表機構辦理注冊事務的,應當提供《外國企業常駐中國代表機構登記證》復印件。境外生產廠商委托境內的代理機構負責辦理注冊事項的,需提供經過公證的委托書原件以及受委托的代理機構營業執照復印件;
資料編號(六)保健食品批準證明文件原件(包括保健食品批準證書及其附件和保健食品變更批件);
資料編號(七)確定的檢驗機構出具的受讓方生產的連續3個批號樣品的功效成份或標志性成分、衛生學、穩定性試驗的檢驗報告;
資料編號(八)2年內無違法違規行為的承諾書;
資料編號(九)受讓方生產的連續三個批號的樣品,其數量為檢驗所需量的3倍。
七、對申報資料的要求:
(一)申報資料的一般要求:
1、申報資料首頁為申報資料項目目錄,目錄中申報資料項目按《保健食品技術轉讓產品注冊申請表》中“所附資料”順序排列。每項資料加封頁,封頁上注明產品名稱、申請人名稱,右上角注明該項資料名稱。各項資料之間應當使用明顯的區分標志,并標明各項資料名稱或該項資料所在目錄中的序號。整套資料用打孔夾裝訂成冊。
2、申報資料使用A4規格紙張打印(中文不得小于宋體小4號字,英文不得小于12號字),內容應完整、清楚,不得涂改。
3、技術轉讓產品注冊申請應提交原件1份。
4、除《保健食品注冊申請表》、檢驗機構出具的檢驗報告、公證文書、官方證明文件及第三方證明文件外,申報資料應逐頁加蓋申請人印章或騎縫章,多個申請人聯合申報的,應加蓋所有申請人印章,技術轉讓應加蓋轉讓方和受讓方印章。印章應加蓋在文字處。印章應符合國家有關用章規定,并具法律效力。進口保健食品申請人若無印章,可以法人代表簽字或簽名章代替。
5、多個申請人聯合申報的,應提交聯合申報負責人推薦書。
6、申報資料中同一內容(如產品名稱、申請人名稱、申請人地址等)的填寫應前后一致。電子版與文字版的同一內容(產品名稱、申請人名稱、申請人地址、產品配方、試制單位名稱、試制單位地址、試驗單位名稱、產品受理編號)應當一致。
7、產品配方、生產工藝、質量標準、標簽與說明書及有關證明文件中的外文,均應譯為規范的中文;外文參考文獻中的摘要、關鍵詞及與產品保健功能、安全有關部分的內容應譯為規范的中文(外國人名、地址除外)。
8、非首次申請的申報資料應提供撤審通知書或不予批準通知書復印件(加蓋申請人公章),還應提供再次申報的理由,附于申報資料的首頁。
9、技術轉讓產品注冊申請中,申請人營業執照的名稱、地址與保健食品批準證書中申請人名稱、地址應當一致。對于不一致的情況,應當要求申請人提供已經備案的證明資料(加蓋申請人單位公章)。
10、對于變更申請、技術轉讓產品注冊申請,申請人應當在保健食品批準證書有效期屆滿3個月前提出;再注冊申請已受理的,不再同時受理該產品的變更和技術轉讓產品注冊申請;已受理的產品變更和技術轉讓產品注冊申請,申請人應當在獲得批準后30日內提出再注冊申請。
11、上述各類復印件應當加蓋原件持有單位公章。
(二)申報資料的具體要求:
1、保健食品技術轉讓產品注冊申請表。
(1) 保健食品技術轉讓產品注冊申請表可從國家食品藥品監督管理局網站(www.sfda.gov.cn)或國家食品藥品監督管理局保健食品審評中心網站(www. bjsp.gov.cn)下載。
(2)填寫前應認真閱讀填表須知,按要求填寫。
(3)申請表內容須打印填寫,項目填寫應完整、規范,不得涂改。
(4)申報的保健功能應與國家食品藥品監督管理局公布的保健食品功能名稱一致。申報的新功能除外。
(5)進口保健食品申請人為產品所有權的擁有者,生產企業為產品的實際生產者(申報產品由申請人自行生產的,生產企業即為申請人;申報產品由申請人委托境外其它企業生產的,生產企業即為被委托企業)。
(6)產品名稱應包括品牌名、通用名和屬性名。
2、受讓方生產國(地區)允許該產品生產銷售的證明文件,該證明文件應當經生產國(地區)的公證機關公證和駐所在國中國使領館確認。
3、受讓方所在國家(地區)有關機構出具的該產品生產企業符合當地相應生產質量管理規范的證明文件。
4、轉讓合同。該合同必須經受讓方所在國家(地區)公證機關公證和駐所在地中國使領館確認。應譯為規范的中文,并經中國境內公證機構公證。
5、由境外廠商常駐中國代表機構辦理注冊事務的,應當提供《外國企業常駐中國代表機構登記證》復印件。境外生產廠商委托境內的代理機構負責辦理注冊事項的,需提供經過公證的委托書原件以及受委托的代理機構營業執照復印件(申請人應當分別申請延續、變更、補發、糾錯等事項,在完成一個申請事項后,方可申請其他事項)。
6、保健食品批準證明文件原件(包括保健食品批準證書及其附件和保健食品變更批件)。
7、確定的檢驗機構出具的受讓方生產的連續3個批號樣品的功效成份或標志性成分、衛生學、穩定性試驗的檢驗報告。
8、2年內無違法違規行為的承諾書。
9、受讓方生產的連續3個批號的樣品,其數量為檢驗所需量的3倍。
八、申辦流程示意圖:

九、許可程序:
(一)受理:
申請人向行政受理服務中心提出申請,按照本《須知》第六條所列目錄提交申請材料,受理中心工作人員按照“《保健食品注冊管理辦法》附件三:進口保健食品在境外轉讓產品注冊申請申請資料項目”對申請材料進行形式審查。申請事項依法不需要取得行政許可的,應當即時告知申請人不受理;申請事項依法不屬于本行政機關職權范圍的,應當即時作出不予受理的決定,并告知申請人向有關行政機關申請;申請材料存在可以當場更正的錯誤的,應當允許申請人當場更正;申請材料不齊全或者不符合法定形式的,應當當場或者在五日內一次告知申請人需要補正的全部內容,逾期不告知的,自收到申請材料之日起即為受理;申請事項屬于本行政機關職權范圍,申請材料齊全、符合法定形式,或者申請人按照本行政機關的要求提交全部補正申請材料的,應當受理行政許可申請。
(二)檢驗與核查:
自受理之日起,國家食品藥品監督管理局在5日內向確定的檢驗機構發出檢驗通知書并提供檢驗用樣品。根據需要,國家食品藥品監督管理局可以對受讓方產品的生產現場進行核查。
收到檢驗通知書和樣品的檢驗機構,應當在30日內對樣品進行樣品檢驗,將檢驗報告報送國家食品藥品監督管理局,同時抄送申請人。
(三)技術審評和行政審查:
國家食品藥品監督管理局應當在收到樣品檢驗報告后的20日內作出審查決定。在審查過程中,需要補充資料的,國家食品藥品監督管理局應當一次性提出。申請人應當在收到補充資料通知書后的5個月內提交符合要求的補充資料,未按規定時限提交補充資料的予以退審。特殊情況,不能在規定時限內提交補充資料的,必須向國家食品藥品監督管理局提出書面申請,并說明理由。申請人補充資料時間不計入許可時限,其審查時限在原審查時限的基礎上延長30日。準予注冊的,向受讓方頒發新的《進口保健食品批準證書》和新的批準文號,證書的有效期不變,同時收繳并注銷轉讓方原取得的《進口保健食品批準證書》。不予注冊的,應當書面說明理由。
(四)送達:自行政許可決定作出之日起10日內,SFDA行政受理服務中心將行政許可決定送達申請人。
十、承諾時限:
自受理之日起,在55日內作出許可決定。
十一、實施機關:
實施機關:國家食品藥品監督管理局
受理地點:國家食品藥品監督管理局行政受理服務中心
十二、許可證件有效期與延續:
新發的《進口保健食品批準證書》有效期與原證書相同,有效期屆滿需要延長有效期的,申請人應當在有效期屆滿三個月前申請再注冊。
十三、許可年審或年檢:無
十四、受理咨詢與投訴機構:
咨詢:國家食品藥品監督管理局
投訴:國家食品藥品監督管理局駐局監察局、政策法規司執法監督處
注:本須知工作期限以工作日計算,不含法定節假日
 標簽:產品注冊 保健食品注冊 許可 行政許可 食品安全法 進口 保健食品
標簽:產品注冊 保健食品注冊 許可 行政許可 食品安全法 進口 保健食品 










